Projet TraPrea : « Dynamique de transmission des entérobactéries productrices de bêta-lactamases à spectre élargi en Réanimation »
Les unités de soins intensifs (USI) sont des foyers majeurs de propagation des entérobactéries productrices de bêta-lactamases à spectre élargi (E-BLSE), qui sont des bactéries multi-résistantes aux antibiotiques, au sein des hôpitaux. L’émergence des E-BLSE en USI peut être attribuée à plusieurs facteurs : le portage préexistant chez les patients nouvellement admis, l’acquisition in vivo d’isolats résistants au sein de l’USI à partir d’un donneur, ou le transfert in vivo de gènes codant pour une BLSE d’une souche bactérienne à une autre. Par conséquent, étant donné les options thérapeutiques limitées contre les E-BLSE, il est urgent d’améliorer le contrôle de leur propagation nosocomiale grâce à des stratégies de prévention efficaces. Cependant, une compréhension exhaustive de la transmissibilité des E-BLSE reste largement incomplète en USI, notamment dans les régions tropicales telles que la Guadeloupe. Ce projet, initié en 2022 et financé par le Fonds Européen de Développement Régional, associe la modélisation mathématique, l’analyse génomique, l’épidémiologie, la santé publique et la microbiologie afin d’enrichir considérablement notre compréhension des facteurs individuels et organisationnels qui influent sur la propagation des E-BLSE et des gènes de résistance en USI. Ces stratégies seront probablement transposables à d’autres USI, en particulier ceux des départements d’outre-mer.
Projet ACRAS-R : « Antimicrobial Resistance transmission routes in Caribbean islands: a One-Health risk analysis »
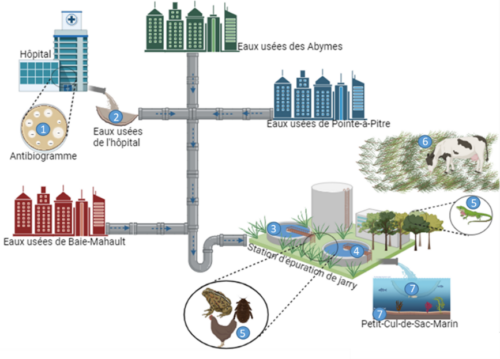
Dans le contexte de la lutte contre la résistance aux antibiotiques, il est impératif de combler les lacunes de connaissances concernant son impact sur l’environnement afin d’évaluer adéquatement les risques associés et de mettre en œuvre des mesures appropriées. Le projet ACRAS-R s’engage à répondre à cette nécessité en étudiant les voies de transmission de la résistance aux antibiotiques, depuis les environnements cliniques tels que les effluents hospitaliers jusqu’aux écosystèmes naturels comme les océans et les populations animales sauvages. De surcroît, il examine l’impact des voyages internationaux et du tourisme sur la dissémination de la résistance aux antibiotiques.
Ce projet collaboratif, soutenu par l’Agence Nationale de la Recherche et lancé en 2021, adopte une approche globale et multidisciplinaire en intégrant l’analyse du résistome et du microbiome, ainsi que l’étude des isolats d’Escherichia coli, qu’ils soient sensibles ou résistants (incluant le génome et le plasmidome). Les données collectées et générées seront intégrées dans un modèle mathématique afin d’identifier et de quantifier le rôle des différentes voies de transmission, et de simuler des stratégies de contrôle hypothétiques visant à évaluer celles qui minimisent la propagation de la résistance aux antibiotiques.
Projet GwaKlebs : « Klebsiella pneumoniae en Guadeloupe chez l’homme, l’animal et leur environnement »
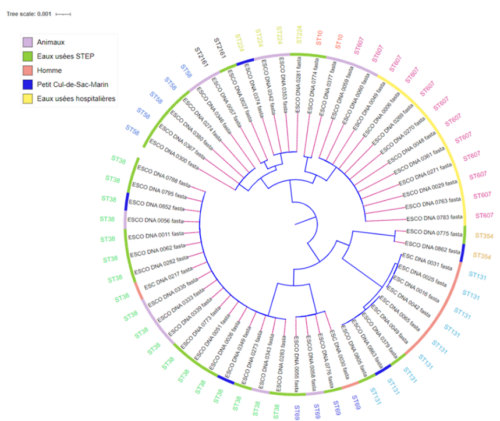
Klebsiella pneumoniae constitue un grave problème de santé publique en raison de son potentiel à engendrer des infections sévères et de sa propension à développer une résistance aux antibiotiques, ce qui rend leur traitement considérablement plus complexe. Notre étude menée en Guadeloupe entre 2018 et 2020 a mis en lumière une transmission limitée des isolats de Klebsiella pneumoniae entre les humains, les animaux domestiques et d’élevage, ainsi que l’environnement. En revanche, nous avons identifié l’hôpital comme le foyer central de la résistance aux antibiotiques, résultant de la dissémination nosocomiale de clones de Klebsiella pneumoniae multirésistants et de gènes de résistance aux antibiotiques. Des obstacles écologiques et/ou une exposition restreinte pourraient entraver la propagation de ces souches entre les différents compartiments. Ces conclusions mettent en évidence l’importance de stratégies de contrôle ciblant les établissements de santé et utilisant la surveillance génomique des clones à haut risque pour freiner leur propagation.